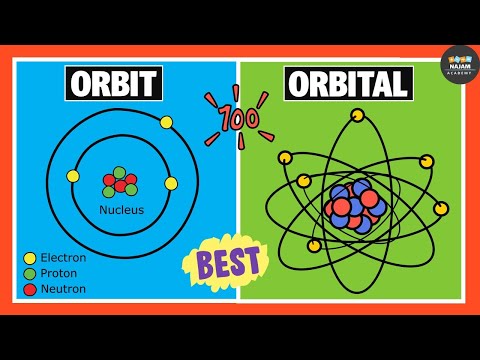
कक्षा और कक्षीय के बीच मुख्य अंतर यह है कि कक्षा एक वृत्ताकार मार्ग है जिसमें एक केंद्रीय बिंदु के चारों ओर एक निश्चित पथ होता है जबकि कक्षीय एक परमाणु के नाभिक के चारों ओर एक अनिश्चित क्षेत्र होता है।
यद्यपि "कक्षा" और "कक्षीय" शब्द समान लगते हैं, ये दो अलग-अलग शब्द हैं। कक्षा शब्द मुख्य रूप से ग्रहों से संबंधित है जबकि कक्षीय शब्द परमाणुओं से संबंधित है। इसके अलावा, एक कक्षा के माध्यम से किसी वस्तु की सटीक गति को निर्धारित करना संभव है, लेकिन एक कक्ष के माध्यम से किसी वस्तु की गति अनिश्चित है।
कक्षा क्या है?
एक कक्षा किसी वस्तु का गुरुत्वीय रूप से घुमावदार प्रक्षेपवक्र है, जैसे किसी तारे के चारों ओर किसी ग्रह का प्रक्षेपवक्र।यह शब्द मुख्य रूप से भौतिकी के अंतर्गत आता है, रसायन विज्ञान के अंतर्गत नहीं। हालाँकि, आइए इस विषय पर कुछ विवरणों पर चर्चा करें ताकि कक्षा और कक्षीय के बीच के अंतर को समझ सकें।

चित्र 1: उपग्रह कुछ कक्षाओं में पृथ्वी के चारों ओर घूमते हैं
आमतौर पर, एक कक्षा एक दोहराए जाने वाले प्रक्षेपवक्र को संदर्भित करती है। कभी-कभी, यह गैर-दोहराए जाने वाले प्रक्षेपवक्र को भी संदर्भित कर सकता है। एक कक्षा अदृश्य है क्योंकि यह एक मार्ग है, वस्तु नहीं। लेकिन, हम इस मार्ग के आयामों को इस मार्ग से गुजरने वाली वस्तुओं की जांच करके निर्धारित कर सकते हैं। गुरुत्वाकर्षण बल जैसा एक बल इस मार्ग का निर्माण करता है जो गतिमान वस्तु को एक घुमावदार/वृत्ताकार गति में खींचता है।
एक कक्षीय क्या है?
एक कक्षीय एक गणितीय कार्य है जो एक परमाणु में या तो एक इलेक्ट्रॉन या इलेक्ट्रॉनों की एक जोड़ी के तरंग-समान व्यवहार का वर्णन करता है।मूल रूप से, यह वह क्षेत्र है जहां हम किसी बिंदु पर किसी बिंदु पर इलेक्ट्रॉन ढूंढ सकते हैं। हालांकि, एक इलेक्ट्रॉन की गति एक निश्चित मार्ग में नहीं होती है। इस प्रकार, एक कक्षक कक्षा के रूप में एक निश्चित वृत्ताकार मार्ग नहीं है। इसके अलावा, हम इलेक्ट्रॉन की सटीक स्थिति या इसकी सटीक गति का निर्धारण नहीं कर सकते हैं। हम केवल परमाणु नाभिक के चारों ओर इलेक्ट्रॉन के मिलने की प्रायिकता निर्धारित कर सकते हैं। इसलिए, कक्षक परमाणु में एक विशिष्ट क्षेत्र है।

चित्र 2: परमाणु नाभिक के चारों ओर इलेक्ट्रॉन बादल
इसके अलावा, मूल्यों का एक अनूठा सेट है जिसका उपयोग हम परमाणु कक्षीय को विस्तार से चित्रित करने के लिए कर सकते हैं। हम उन्हें क्वांटम संख्या कहते हैं।
1. इलेक्ट्रॉन का ऊर्जा स्तर (n)
2. कोणीय संवेग संख्या (l)
3. चुंबकीय क्वांटम संख्या (एम)
4. स्पिन क्वांटम संख्या (एस)
हम एक परमाणु कक्षक को परमाणु नाभिक के चारों ओर एक इलेक्ट्रॉन बादल के रूप में दिखा सकते हैं। अत: कक्षक परमाणु में एक विशिष्ट क्षेत्र है।
ऑर्बिट और ऑर्बिटल में क्या अंतर है?
एक कक्षा किसी वस्तु का गुरुत्वाकर्षण रूप से घुमावदार प्रक्षेपवक्र है, जैसे किसी तारे के चारों ओर एक ग्रह का प्रक्षेपवक्र जबकि एक कक्षीय एक गणितीय कार्य है जो एक इलेक्ट्रॉन या इलेक्ट्रॉनों की एक जोड़ी के तरंग-समान व्यवहार का वर्णन करता है। एक परमाणु। इसलिए, कक्षा और कक्षीय के बीच महत्वपूर्ण अंतर यह है कि कक्षा एक केंद्रीय बिंदु के चारों ओर एक निश्चित पथ वाला एक गोलाकार मार्ग है जबकि कक्षीय एक परमाणु के नाभिक के चारों ओर एक अनिश्चित क्षेत्र है।
कक्षा और कक्षीय के बीच एक महत्वपूर्ण अंतर यह है कि कक्षा का एक गोलाकार आकार होता है जबकि कक्षीय का कोई परिभाषित आकार नहीं होता है। उदाहरण के लिए, तारों के चारों ओर ग्रहों की गति, ग्रहों के चारों ओर एक उपग्रह आदि कक्षाओं के माध्यम से होते हैं जबकि परमाणु नाभिक के चारों ओर इलेक्ट्रॉनों की गति कक्षाओं के माध्यम से होती है।
नीचे इन्फोग्राफिक ऑर्बिट और ऑर्बिटल के बीच अंतर पर अधिक विवरण प्रदान करता है।

सारांश – कक्षा बनाम कक्षीय
ऑर्बिट और ऑर्बिटल्स दोनों अदृश्य हैं क्योंकि वे ऑब्जेक्ट नहीं बल्कि पाथवे हैं। हालांकि ये दोनों शब्द एक जैसे लगते हैं, लेकिन ये एक दूसरे से बहुत अलग हैं। ऑर्बिटल और ऑर्बिटल के बीच महत्वपूर्ण अंतर यह है कि ऑर्बिट एक सर्कुलर पाथवे है जिसमें एक केंद्रीय बिंदु के चारों ओर एक निश्चित पथ होता है जबकि ऑर्बिटल एक परमाणु के नाभिक के चारों ओर एक अनिश्चित क्षेत्र होता है।