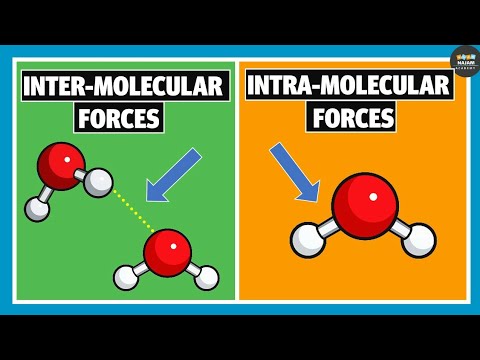
मुख्य अंतर - इंटरमॉलिक्युलर बनाम इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग
हाइड्रोजन बंधन कुछ ध्रुवीय अणुओं के बीच आकर्षण बल का एक रूप है। यह आयनिक या सहसंयोजक बंधों की तुलना में एक प्रकार का कमजोर बंधन है, लेकिन द्विध्रुवीय-द्विध्रुवीय बलों और वैन डेर वाल बलों की तुलना में मजबूत आकर्षण बल हैं। एक हाइड्रोजन बंधन बनता है यदि ध्रुवीय अणु में एक अकेला इलेक्ट्रॉन जोड़ी (जो एक इलेक्ट्रॉन दाता के रूप में कार्य कर सकता है) के साथ एक हाइड्रोजन परमाणु (एक इलेक्ट्रॉन स्वीकर्ता) से बंधे हुए एक मजबूत विद्युतीय परमाणु होता है। चूँकि प्रबल विद्युत ऋणात्मक परमाणु हाइड्रोजन परमाणु की तुलना में बंध इलेक्ट्रॉन को अपनी ओर आकर्षित कर सकता है, इसलिए हाइड्रोजन परमाणु को आंशिक धनात्मक आवेश प्राप्त होता है, जिसके परिणामस्वरूप एक प्रबल आवेश पृथक्करण होता है।इसलिए, रासायनिक बंधन बनाने वाले सामान्य हाइड्रोजन बंधन ओ-एच बंधन, एनएच बंधन और एफ-एच बंधन हैं। हाइड्रोजन बांड के दो रूप हैं जो बन सकते हैं; इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग जो ध्रुवीय अणुओं और इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग के बीच होती है जो एक ही अणु में होती है। इंटरमॉलिक्युलर और इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग के बीच महत्वपूर्ण अंतर यह है कि इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग दो अणुओं के बीच होती है जबकि इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग एक अणु में होती है।
इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग क्या है?
एक पदार्थ में अलग-अलग अणुओं के बीच इंटरमॉलिक्युलर हाइड्रोजन बॉन्ड होते हैं। इसलिए, इलेक्ट्रॉन दाता और इलेक्ट्रॉन स्वीकर्ता दो अलग-अलग अणुओं में मौजूद होना चाहिए। यदि उचित इलेक्ट्रॉन दाता और स्वीकर्ता मौजूद हैं, तो कोई भी अणु हाइड्रोजन बांड बना सकता है।

चित्र 01: पानी के अणुओं में अंतर-आणविक हाइड्रोजन बंधन
अणुओं के लिए एक सामान्य उदाहरण जो इंटरमॉलिक्युलर हाइड्रोजन बॉन्ड बना सकते हैं, वे हैं पानी के अणु (H2O)। पानी के अणुओं के बीच हाइड्रोजन बॉन्ड एक कठोर संरचना का निर्माण करते हैं। जब तरल पानी ठोस बर्फ में बदल जाता है।
इंट्रामोलेक्युलर हाइड्रोजन बॉन्डिंग क्या है?
इंट्रामोलेक्युलर हाइड्रोजन बॉन्ड वे होते हैं जो एक अणु के भीतर होते हैं। इस प्रकार की हाइड्रोजन बॉन्डिंग तब उत्पन्न होती है जब दो कार्यात्मक समूह जो एक दूसरे के साथ हाइड्रोजन बॉन्ड बनाने में सक्षम होते हैं, एक ही अणु में मौजूद होते हैं। इसका मतलब है कि इलेक्ट्रॉन दाता और इलेक्ट्रॉन स्वीकर्ता दोनों एक ही अणु में मौजूद होने चाहिए।

चित्रा 02: सैलिसिल्डिहाइड में इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग
इसके अलावा, इन दो कार्यात्मक समूहों को इस हाइड्रोजन बांड के लिए काफी करीब स्थित होना चाहिए। एक अणु का सबसे आम उदाहरण जो इस प्रकार के हाइड्रोजन बंधन को दर्शाता है वह है सैलिसिलैल्डिहाइड(C7H6O2).
इंटरमॉलिक्युलर और इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग में क्या अंतर है?
इंटरमॉलिक्युलर बनाम इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग |
|
| एक पदार्थ में अलग-अलग अणुओं के बीच अंतर-आणविक हाइड्रोजन बांड होते हैं। | इंट्रामोलेक्युलर हाइड्रोजन बांड वे होते हैं जो एक एकल अणु के भीतर होते हैं। |
| अवयव | |
| दो अणुओं के बीच इंटरमॉलिक्युलर हाइड्रोजन बॉन्ड बनते हैं। | अलग-अलग अणुओं के बीच इंट्रामोल्युलर हाइड्रोजन बॉन्ड बनते हैं। |
सारांश - इंटरमॉलिक्युलर बनाम इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग
हाइड्रोजन आबंध द्विध्रुव-द्विध्रुवीय अंतःक्रिया का एक रूप है। लेकिन यह एक कमजोर बंधन प्रकार है। इंटरमॉलिक्युलर और इंट्रामोल्युलर हाइड्रोजन बॉन्ड के रूप में हाइड्रोजन बॉन्डिंग के दो रूप हैं। इंटरमॉलिक्युलर और इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग के बीच अंतर यह है कि इंटरमॉलिक्युलर हाइड्रोजन बॉन्डिंग दो अणुओं के बीच होती है जबकि इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग एक अणु में होती है।