अरहेनियस और आईरिंग समीकरण के बीच मुख्य अंतर यह है कि अरहेनियस समीकरण एक अनुभवजन्य समीकरण है जबकि आईरिंग समीकरण सांख्यिकीय यांत्रिक औचित्य पर आधारित है।
अरहेनियस समीकरण और आईरिंग समीकरण भौतिक रसायन विज्ञान में दो महत्वपूर्ण समीकरण हैं। जब हम सक्रियण की निरंतर एन्थैल्पी और सक्रियण की निरंतर एन्ट्रॉपी मान रहे हैं, तो आईरिंग समीकरण अनुभवजन्य अरहेनियस समीकरण के समान है।
अरहेनियस समीकरण क्या है?
अरहेनियस समीकरण एक रासायनिक सूत्र है जिसमें प्रतिक्रिया दर की तापमान निर्भरता शामिल है। यह समीकरण 1889 में वैज्ञानिक Svante Arrhenius द्वारा प्रस्तावित और विकसित किया गया था।रासायनिक प्रतिक्रियाओं की दर निर्धारित करने और सक्रियण की ऊर्जा की गणना में अरहेनियस समीकरण के कई अनुप्रयोग हैं। इस संदर्भ में, अरहेनियस समीकरण सूत्र के लिए एक भौतिक औचित्य और व्याख्या प्रदान करता है। इसलिए, हम इसे एक अनुभवजन्य संबंध के रूप में पहचान सकते हैं। अरहेनियस समीकरण इस प्रकार व्यक्त किया गया है:
के=एई(ईए/आरटी)
जहां k प्रतिक्रिया मिश्रण के लिए स्थिर दर है, T केल्विन में सिस्टम का पूर्ण तापमान है, A रासायनिक प्रतिक्रिया के लिए पूर्व-घातीय कारक है, E प्रतिक्रिया के लिए सक्रियण ऊर्जा है और R है सार्वभौमिक गैस स्थिरांक। इस समीकरण में, पूर्व-घातांक कारक ए की इकाइयों पर विचार करते समय, यह दर स्थिरांक की इकाइयों के समान है जो प्रतिक्रिया के क्रम पर निर्भर करेगा। उदा. यदि प्रतिक्रिया पहले क्रम की है, तो A की इकाइयाँ प्रति सेकंड (s-1) हैं। दूसरे शब्दों में, इस प्रतिक्रिया में, ए प्रति सेकंड टकराव की संख्या है जो उचित अभिविन्यास में होती है।इसके अलावा, यह संबंध बताता है कि या तो तापमान में वृद्धि या सक्रियण ऊर्जा कम होने से प्रतिक्रिया की दर में वृद्धि होगी।

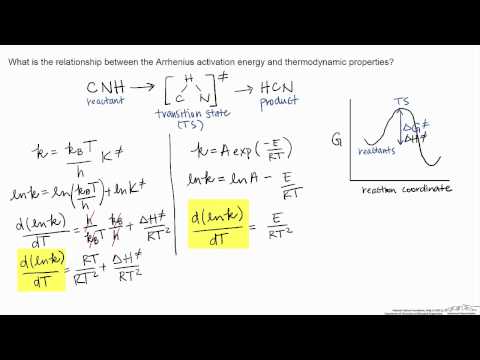
चित्र 01: अरहेनियस समीकरण के विभिन्न डेरिवेटिव
क्या विचार समीकरण?
इरिंग समीकरण एक समीकरण है जो प्रतिक्रिया मिश्रण के तापमान के खिलाफ रासायनिक प्रतिक्रिया की दर में परिवर्तन का वर्णन करता है। इस समीकरण को हेनरी आइरिंग ने 1935 में दो अन्य वैज्ञानिकों के साथ मिलकर विकसित किया था। आईरिंग समीकरण अरहेनियस समीकरण के समान है जब सक्रियण की निरंतर एन्थैल्पी और सक्रियण की निरंतर एन्ट्रॉपी पर विचार किया जाता है। आईरिंग समीकरण का सामान्य सूत्र इस प्रकार है:

यहाँ G‡ सक्रियण की गिब्स ऊर्जा है, संचरण गुणांक है, kB बोल्ट्ज़मान स्थिरांक है, और h प्लैंक स्थिरांक है।
अरहेनियस और आईरिंग समीकरण में क्या अंतर है?
अरहेनियस और आईरिंग समीकरण भौतिक रसायन विज्ञान में महत्वपूर्ण समीकरण हैं। अरहेनियस और आईरिंग समीकरण के बीच महत्वपूर्ण अंतर यह है कि अरहेनियस समीकरण एक अनुभवजन्य समीकरण है जबकि ईयरिंग समीकरण सांख्यिकीय यांत्रिक औचित्य पर आधारित है। इसके अलावा, अरहेनियस समीकरण का उपयोग प्रसार गुणांक के तापमान भिन्नता, क्रिस्टल रिक्तियों की आबादी, रेंगने की दर और कई अन्य थर्मली-प्रेरित प्रक्रियाओं को मॉडल करने के लिए किया जाता है, जबकि आइरिंग समीकरण संक्रमण राज्य सिद्धांत में उपयोगी है और वहां इसे सक्रिय के रूप में जाना जाता है -जटिल सिद्धांत।
अगल-बगल तुलना के लिए नीचे इन्फोग्राफिक अरहेनियस और आईरिंग समीकरण के बीच अंतर को सारणीबद्ध करता है।

सारांश - अरहेनियस बनाम आईरिंग समीकरण
अरहेनियस और आईरिंग समीकरण भौतिक रसायन विज्ञान में महत्वपूर्ण समीकरण हैं। अरहेनियस और आईरिंग समीकरण के बीच महत्वपूर्ण अंतर यह है कि अरहेनियस समीकरण एक अनुभवजन्य समीकरण है जबकि ईयरिंग समीकरण सांख्यिकीय यांत्रिक औचित्य पर आधारित है। अरहेनियस समीकरण का उपयोग प्रसार गुणांक के तापमान भिन्नता, क्रिस्टल रिक्तियों की आबादी, रेंगने की दर और कई अन्य थर्मली-प्रेरित प्रक्रियाओं के मॉडल के लिए किया जाता है। दूसरी ओर, आइरिंग समीकरण, संक्रमण अवस्था सिद्धांत में उपयोगी है, और वहाँ, इसे सक्रिय-जटिल सिद्धांत के रूप में जाना जाता है।