आयनिक और सहसंयोजक बंधों के बीच महत्वपूर्ण अंतर यह है कि आयनिक बंधन बहुत भिन्न इलेक्ट्रोनगेटिविटी वाले परमाणुओं के बीच होते हैं जबकि सहसंयोजक बंधन समान या बहुत कम इलेक्ट्रोनगेटिविटी अंतर वाले परमाणुओं के बीच होते हैं।
जैसा कि अमेरिकी रसायनज्ञ जीएन लुईस ने प्रस्तावित किया था कि परमाणु स्थिर होते हैं जब उनके वैलेंस शेल में आठ इलेक्ट्रॉन होते हैं। अधिकांश परमाणुओं की संयोजकता कोशों में आठ से कम इलेक्ट्रॉन होते हैं (आवर्त सारणी के समूह 18 में उत्कृष्ट गैसों को छोड़कर); इसलिए, वे स्थिर नहीं हैं। ये परमाणु स्थिर होने के लिए एक दूसरे के साथ प्रतिक्रिया करते हैं। इस प्रकार, प्रत्येक परमाणु एक उत्कृष्ट गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सकता है।आयनिक और सहसंयोजक बंधन दो प्रमुख प्रकार के रासायनिक बंधन हैं, जो एक रासायनिक यौगिक में परमाणुओं को जोड़ते हैं।

आयनिक बांड क्या हैं?
परमाणु इलेक्ट्रॉन प्राप्त कर सकते हैं या खो सकते हैं और ऋणात्मक या धनात्मक आवेशित कण बना सकते हैं; जिसे हम आयन कहते हैं। आयनों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन होते हैं। आयनिक बंधन इन विपरीत आवेशित आयनों के बीच आकर्षक बल है। एक आयनिक बंधन में परमाणुओं की इलेक्ट्रोनगेटिविटी काफी हद तक आयनों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन की ताकत को प्रभावित करती है।

चित्र 01: सोडियम और क्लोरीन परमाणुओं के बीच एक आयनिक बंधन का निर्माण
इलेक्ट्रोनगेटिविटी इलेक्ट्रॉनों के लिए परमाणुओं की आत्मीयता का माप है। उच्च इलेक्ट्रोनगेटिविटी वाला परमाणु कम इलेक्ट्रोनगेटिविटी वाले परमाणु से एक आयनिक बंधन बनाने के लिए इलेक्ट्रॉनों को आकर्षित कर सकता है। उदाहरण के लिए, सोडियम क्लोराइड में सोडियम आयन और क्लोराइड आयन के बीच एक आयनिक बंधन होता है। सोडियम एक धातु है और क्लोरीन एक अधातु है; इसलिए, इसमें क्लोरीन (3.0) की तुलना में बहुत कम इलेक्ट्रोनगेटिविटी (0.9) है। इस इलेक्ट्रोनगेटिविटी अंतर के कारण, क्लोरीन सोडियम से एक इलेक्ट्रॉन को आकर्षित कर सकता है और Cl– बना सकता है, उसी समय, सोडियम Na+ आयन बनाता है। इस वजह से, दोनों परमाणु स्थिर नोबल गैस इलेक्ट्रॉनिक कॉन्फ़िगरेशन प्राप्त करते हैं। Cl– और Na+आकर्षक इलेक्ट्रोस्टैटिक बलों द्वारा एक साथ रखे जाते हैं, इस प्रकार एक आयनिक बंधन बनाते हैं; Na-Cl बांड।
सहसंयोजक बांड क्या हैं?
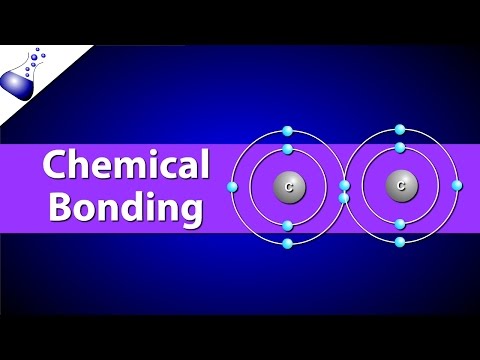
जब दो परमाणु, समान या बहुत कम इलेक्ट्रोनगेटिविटी अंतर वाले, एक साथ प्रतिक्रिया करते हैं, तो वे इलेक्ट्रॉनों को साझा करके एक सहसंयोजक बंधन बनाते हैं। इस प्रकार, दोनों परमाणु इलेक्ट्रॉनों को साझा करके उत्कृष्ट गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सकते हैं।अणु वह उत्पाद है जो परमाणुओं के बीच सहसंयोजक बंधों के निर्माण के परिणामस्वरूप होता है। उदाहरण के लिए, एक ही तत्व के परमाणु मिलकर अणु बनाते हैं जैसे Cl2, H2, या P4, प्रत्येक परमाणु सहसंयोजक बंधन के माध्यम से दूसरे के साथ बंधता है।

चित्र 02: मीथेन अणु में कार्बन और हाइड्रोजन परमाणुओं के बीच सहसंयोजक बंधन
मीथेन अणु (CH4) में कार्बन और हाइड्रोजन परमाणुओं के बीच सहसंयोजक बंधन भी होते हैं; एक केंद्रीय कार्बन परमाणु और चार हाइड्रोजन परमाणुओं (चार सी-एच बांड) के बीच चार सहसंयोजक बंधन होते हैं। मीथेन एक अणु का एक उदाहरण है जिसमें बहुत कम इलेक्ट्रोनगेटिविटी अंतर वाले परमाणुओं के बीच सहसंयोजक बंधन होते हैं।
आयनिक और सहसंयोजक बांड के बीच अंतर क्या है?
आयनिक बनाम सहसंयोजक बांड |
|
| एक आयनिक यौगिक में विपरीत आवेशित आयनों के बीच इलेक्ट्रोस्टैटिक बल के कारण दो परमाणुओं के बीच एक रासायनिक कड़ी। | दो परमाणुओं या आयनों के बीच एक रासायनिक कड़ी जहां इलेक्ट्रॉन जोड़े उनके बीच साझा किए जाते हैं। |
| परमाणुओं की संख्या | |
| धातु और अधातु के बीच होता है। | ज्यादातर दो अधातुओं के बीच होता है। |
| इलेक्ट्रॉनों की संख्या | |
| इलेक्ट्रॉनों का पूर्ण स्थानांतरण होता है। | तब होता है जब दो (या अधिक) तत्व इलेक्ट्रॉनों को साझा करते हैं। |
| यौगिक | |
| आमतौर पर क्रिस्टल के रूप में देखा जाता है, जिसमें कुछ धनात्मक आवेशित आयन ऋणात्मक आवेशित आयन को घेर लेते हैं। | सहसंयोजक बंधों द्वारा बंधे परमाणु अणुओं के रूप में मौजूद होते हैं, जो कमरे के तापमान पर मुख्य रूप से गैस या तरल पदार्थ के रूप में मौजूद होते हैं। |
| ध्रुवीयता | |
| आयनिक बंधों में उच्च ध्रुवता होती है। | सहसंयोजक बंधों में कम ध्रुवता होती है। |
| भौतिक गुण | |
| सहसंयोजक अणुओं की तुलना में आयनिक यौगिकों में बहुत अधिक गलनांक और क्वथनांक होते हैं। | सहसंयोजक अणुओं में आयनिक यौगिकों की तुलना में कम गलनांक और क्वथनांक होते हैं। |
| पानी में घुलनशीलता | |
| ध्रुवीय सॉल्वैंट्स (जैसे पानी) में, आयनिक यौगिक रिलीजिंग आयनों को भंग कर देते हैं; ऐसे समाधान बिजली का संचालन करने में सक्षम हैं। | ध्रुवीय सॉल्वैंट्स में, सहसंयोजक अणु काफी हद तक नहीं घुलते हैं; इसलिए ये समाधान बिजली का संचालन करने में असमर्थ हैं। |
सारांश - आयनिक बनाम सहसंयोजक बांड
आयनिक और सहसंयोजक बंधन दो प्रमुख प्रकार के रासायनिक बंधन हैं जो यौगिकों में मौजूद हैं। आयनिक और सहसंयोजक बंधन के बीच का अंतर यह है कि आयनिक बंधन बहुत अलग इलेक्ट्रोनगेटिविटी वाले परमाणुओं के बीच होते हैं जबकि सहसंयोजक बंधन समान या बहुत कम इलेक्ट्रोनगेटिविटी अंतर वाले परमाणुओं के बीच होते हैं।